Дистанційне навчання. 11 клас
2025-2026 нр.
(Працюємо в робочому зошиті )
УРОК
Всі роботи ( конспекти) виконуємо в робочому зошиті -як з фізики так і з математики- користуйтеся підручником
04 -02 -2026 р.
ФІЗИКА
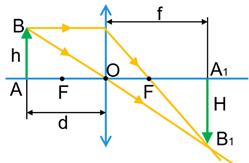
Лінзи . Побудова зображень в лінзах
Як отримати за допомогою лінз збільшене або зменшене зображення предмета?
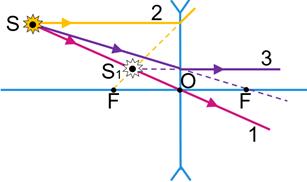
Для побудови зображення в лінзі використовують три найпростіші в побудові промені.
Для збиральної лінзи:
1 — промінь, який проходить через оптичний центр О лінзи, — не заломлюється та не змінює свого напрямку;
2 — промінь, паралельний головній оптичній осі лінзи, — після заломлення в лінзі йде через фокус F;
3 — промінь, який проходить через фокус F — після заломлення в лінзі йде паралельно головній оптичній осі лінзи.
Точка S1 буде дійсним зображенням точки S, якщо в точці S1 перетинаються самі заломлені промені.
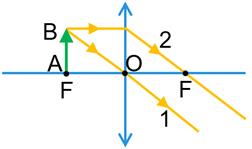
Для розсіювальної лінзи:
1 — промінь, який проходить через оптичний центр О лінзи, — не заломлюється та не змінює свого напрямку;
2 — промінь, паралельний головній оптичній осі лінзи, — після заломлення в лінзі проходить таким чином, що його продовження йде через фокус F;
3 — промінь, який проходить через фокус F — після заломлення в лінзі поширюється паралельно до головної оптичної осі.
Точка S1 буде уявним зображенням точки S, якщо в точці S1 перетинаються продовження заломлених променів.
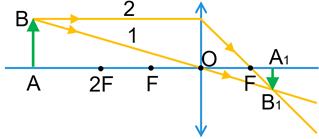
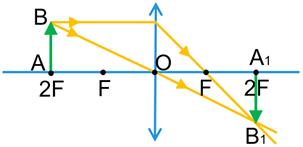
Зображення предмета, яке дає збиральна лінза:
1) Предмет розташований за подвійним фокусом збиральної лінзи.
Зображення предмета є дійсним, зменшеним, перевернутим. Таке зображення виходить, наприклад, на сітківці ока або плівці фотоапарата.
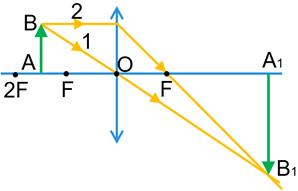
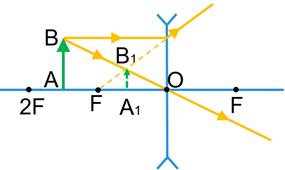
2) Предмет розташований між фокусом і подвійним фокусом збиральної лінзи.
Зображення предмета є дійсним, збільшеним, перевернутим. Таке зображення дозволяє одержати проекційна апаратура на екрані.
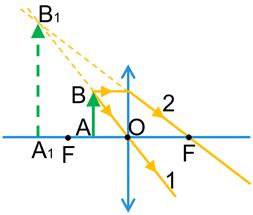
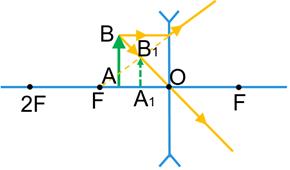
3) Предмет розташований між фокусом і збиральною лінзою.
Зображення предмета є уявним, збільшеним, прямим. Це зображення розташоване по той самий бік від лінзи, що й предмет, тому ми не можемо побачити його на екрані, але бачимо, дивлячись на предмет крізь лінзу. Саме таке зображення дає збільшувальне скло — лупа.
4)Предмет розташований на подвійній фокусній відстані від збиральної лінзи.
Зображення предмета є дійсним, рівним за розміром, перевернутим.
5) Предмет розташований на фокусній відстані від збиральної лінзи.
Усі промені після заломлення йдуть паралельним пучком, отже, у цьому випадку ані дійсного, ані уявного зображення ми не отримаємо.
Зображення предмета, яке дає розсіювальна лінза:
Розсіювальна лінза завжди дає уявне, зменшене, пряме зображення, розташоване з того самого боку від лінзи, що й сам предмет.
Формула тонкої лінзи
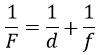
, де
F — фокусна відстань;
d — відстань від предмета до лінзи;
f — відстань від лінзи до зображення.
Під час розв’язування задач слід мати на увазі:• відстань
f (від лінзи до зображення) необхідно брати зі знаком»
«–», якщо зображення є уявним, і зі знаком
«+», якщо зображення є дійсним;
• фокусна відстань
F збиральної лінзи є додатною, а розсіювальної — від’ємною.
Лінійне збільшення Г лінзи — це відношення лінійного розміру Н зображення предмета до розміру h самого предмета.
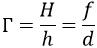
Додому- п. 27, впр. 27 (1-2)
03 -02 -2026 р.
ГЕОМЕТРІЯ
КОНУС (розв*язування задач)
Роботу виконуємо в робочих зошитах
 Обчисліть площу бічної поверхні конуса, осьовим перерізом якого є правильний трикутник зі стороною:
Обчисліть площу бічної поверхні конуса, осьовим перерізом якого є правильний трикутник зі стороною:
12 см 6 см
А 9  см2 Б 18
см2 Б 18 см2 В 36
см2 В 36 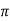 см2 Г 48
см2 Г 48 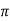 см2 Д 72
см2 Д 72 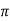 см2
см2
 Знайдіть площу основи конуса, висота якого дорівнює 12 см, а твірна становить:
Знайдіть площу основи конуса, висота якого дорівнює 12 см, а твірна становить:
13 см 15 см
А 25 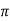 см2 Б 81
см2 Б 81 см2 В 144
см2 В 144 см2 Г 169
см2 Г 169  см2 Д 225
см2 Д 225 см2
см2
- Твірна конуса нахилена до площини основи під кутом 45°. Знайдіть:
 висоту конуса, якщо діаметр основи конуса,
висоту конуса, якщо діаметр основи конуса,
радіус його основи дорівнює 4 см якщо його висота дорівнює 8 см
А 2 см Б 4 см В 8 см Г 16 см Д 32 см
 Знайдіть площу осьового перерізу конуса, діаметр основи і висота якого дорівнюють відповідно:
Знайдіть площу осьового перерізу конуса, діаметр основи і висота якого дорівнюють відповідно:
6 см і 8 см 8 см і 6 см
А 12см2 Б 24см2 В 40 см2 Г 48 см2 Д 96 см2
ДОДОМУ- п. 6 , впр. 6.17.
02- 02- 2026 р.
ФІЗИКА
Заломлення світла (розв*язування задач) .
Світловий промінь переходить із повітря у прозору рідину. Якщо кут падіння променя становить 45°, то кут заломлення дорівнює 30°. На який кут відхиляється промінь від початкового напряму?
 Дано: Розв’язання
Дано: Розв’язання
α = 45° β = α + γ = 450 – 300 = 150
γ = 30°
 β- ?
β- ?

ДОДОМУ- Підготувати лбораторну роботу 5
Урок 52 - 28-08-2026р.
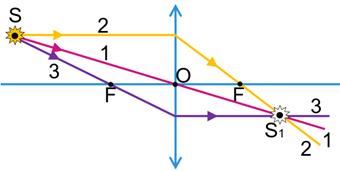
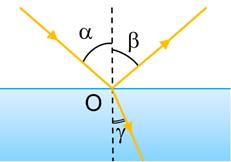
Тема Заломлення світла Закони заломлення.
аломленням світла — це зміна напрямку поширення світла в разі його переходу з одного середовища в інше.
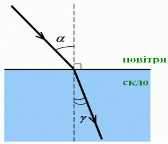
Заломлення світла в разі його переходу з повітря в скло:
α — кут падіння
β — кут відбивання
γ (гамма) — кут заломлення (утворений заломленим променем і перпендикуляром до межі поділу двох середовищ)
Установлення законів заломлення світла:
В разі зменшення кута падіння
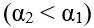
, кут заломлення теж зменшується
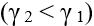
, при цьому:
Закони заломлення світла:
1. Промінь падаючий, промінь заломлений і перпендикуляр до межі поділу середовищ, встановлений із точки падіння променя, лежать в одній площині.
2. Відношення синуса кута падіння до синуса кута заломлення для двох даних середовищ є незмінною величиною:
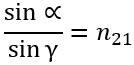
, де
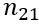
—
відносний показник заломлення.
Чому ж світло, переходячи з одного середовища в інше, змінює свій напрямок?
Швидкість світла у вакуумі — 300 000 км/с. У будь-якому іншому середовищі швидкість світла є меншою, ніж у вакуумі (у воді швидкість світла в 1,33 разу менша, ніж у вакуумі).
Причиною заломлення світла є зміна швидкості поширення світла в разі переходу з одного прозорого середовища в інше.
Прийнято говорити про оптичну густину середовища: чим менша швидкість світла в середовищі, тим більшою є його оптична густина.
Показник заломлення
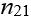
показує, у скільки разів швидкість поширення світла в першому середовищі
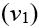
більша (або менша), ніж швидкість поширення світла в другому середовищі
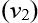
:
За 2−м законом заломлення світла:
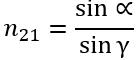
, тому
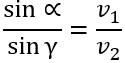
Проаналізувавши останню формулу, бачимо:
- чим більше змінюється швидкість світла, тим більше світло заломлюється;
- якщо промінь світла переходить у середовище з більшою оптичною густиною (тобто швидкість світла зменшується), то кут заломлення є меншим від кута падіння:
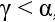 ;
; - якщо промінь світла переходить у середовище з меншою оптичною густиною (тобто швидкість світла збільшується), то кут заломлення є більшим за кут падіння:
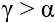 .
.
Абсолютний показник заломлення показує, у скільки разів швидкість поширення світла в середовищі менша, ніж у вакуумі:
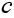
— швидкість поширення світла в вакуумі
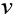
— швидкість поширення світла в середовищі
Як пов’язані між собою абсолютний та відносний показники заломлення?
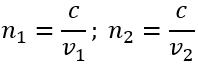
,
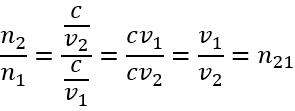
, отже:
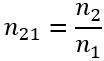
, де
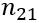
— відносний показник заломлення
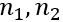
— абсолютні показники заломлення першого і другого середовищ
Задача 1.
Чи може світловий промінь перейти з одного середовища до іншого, не змінивши свого напряму?
Розв'язання:
Так, якщо кут падіння променів на межу розподілу двох середовищ
дорівнює 0°.
Задача 2.
Світловий промінь, який перейшов із повітря у скло, зазнав заломлення. Порівняйте кути падіння та заломлення променя.
Розв'язання
Кут падіння більший, аніж кут заломлення, оскільки скло - більш оптично густе середовище (швидкість світла в повітрі більша, аніж у склі.
Задача 3.
Світловий промінь, який падає знизу на поверхню води, зазнає відбивання та заломлення. У якому з випадків а-г на рисунку правильно показано відбитий і заломлений промені?
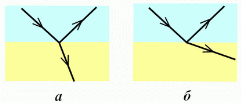
Розв'язання
Встановивши перпендикуляр, бачимо, що підходить тільки пункт a)
.
Задача 4.
У якому з випадків а-г на рисунку правильно показано хід світлового променя, що зазнав заломлення, падаючи з повітря на поверхню прозорого матеріалу?
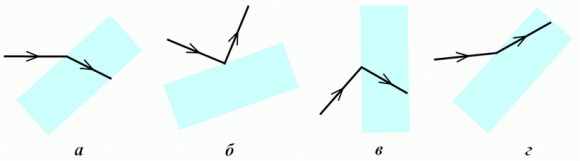
Розв'язання
Встановивши перпендикуляр, бачимо, що підходить тільки пункт а)
б) - промінь не пройшов в прозоре середовище;
в) - неправильно зображений заломлений промінь
г) - неправильне співвідношення між кутом падіння і кутом заломлення
Додому- п.26 впр26 (1-2)
27-01 2026 р.
ГЕОМЕТРІЯ
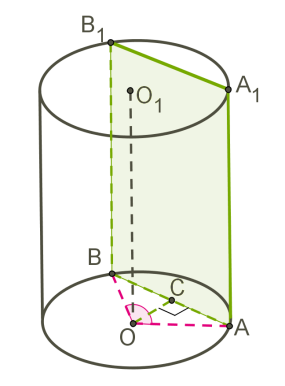
ЦИЛІНДР
Циліндр — це тіло обертання, отримане при обертанні прямокутника навколо його сторони.
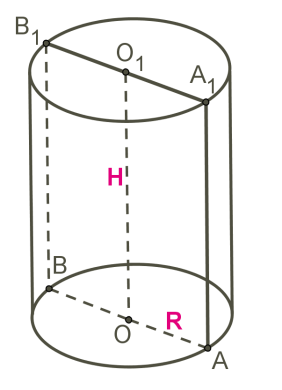
Прямокутник AOO1A1 обертається навколо сторони OO1.
OO1 — вісь симетрії циліндра і висота циліндра.
AA1 — твірна циліндра, довжина якої дорівнює довжині висоти циліндра.
AO — радіус циліндра.
Отримана циліндрична поверхня називається бічною поверхнею циліндра, а круги — основами циліндра.
Осьовий переріз циліндра — це перетин циліндра площиною, яка проходить через вісь циліндра. Цей переріз є прямокутником.
При перерізі циліндра площиною, паралельною осі циліндра (тобто перпендикулярною основі), також виходить прямокутник.
На малюнку зображений циліндр, перетнутий площиною, яка паралельна осі циліндра OO1.
ABB1A1 — прямокутник.
OA=ОB=R — радіуси.
OC — відстань від осі циліндра до площини перерізу.
Дуга AB дорівнює центральному куту AOB.
Який відрізок на рисунку є радіусом?
варіанти відповідей
Який відрізок на рисунку є висотою?
варіанти відповідей
Який відрізок на рисунку є твірною?
варіанти відповідей
Основи циліндра лежать у:
варіанти відповідей
Площинах, що перетинаються
Перпендикулярних площинах
Висота циліндра дорівнює:
варіанти відповідей
Діагоналі осьового перезіру
Довжині кола
ДОДОМУ- П. 5 , впр. 5.7 , 5.9
28-о1- 2026 р.
АЛГЕБРА
Первісна та її властивості
Введемо поняття первісної функції та невизначеного інтеграла, розглянемо основні іх властивості.
Функція F(x) називається первісною функції f(x) на даному проміжку, якщо для будь-якого x з цього проміжку F‘(x) = f(x).
Наприклад
Перевірити, чи буде функція F(x)=sinx+2,5x2 первісною функції f(x)= cosx+5х на множині дійсних чисел?
Знайдемо похідну функції F(x), F‘(x) = cosx+2,5*2х, отже F(x) називається первісною функції f(x) на множині дійсних чисел
Таблиця первісних (невизначених інтегралів)

Первісною для у = sinx є:
варіанти відповідей
Первісною для у =1/cos2x є:
варіанти відповідей
ДОДОМУ- П. 8 , впр. 8.2 , 8.4 .
29-01 - 2026 р.
ФІЗИКА
ПОВНЕ ВІДБИВАННЯ СВІТЛА
Дзеркальне відображення: Зображення в дзеркалі виглядає так, ніби воно знаходиться за дзеркалом. Два показані промені - це ті, які вражають дзеркало лише під правильними кутами, щоб відображатися в очах глядача. Зображення, здається, виходить з того напрямку, з якого йдуть промені, коли вони потрапляють в очі глядача.
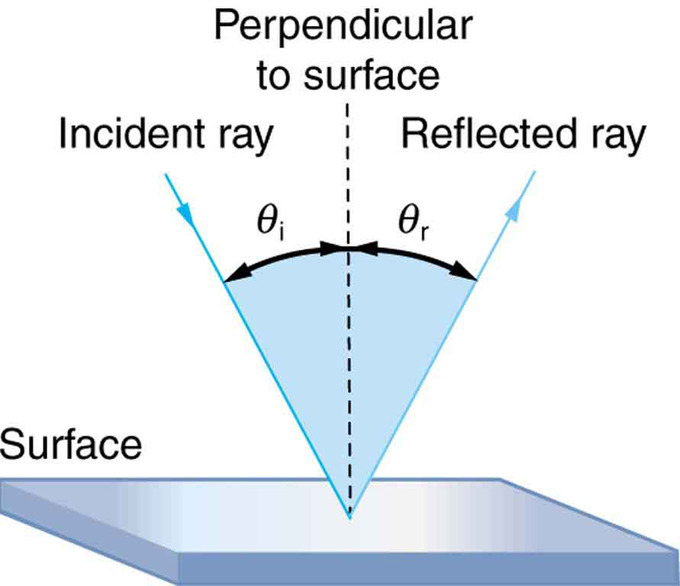
Закон відображення: Закон відбиття стверджує, що кут відбиття дорівнює куту падіння: θ r = θ i. Кути вимірюються щодо перпендикуляра до поверхні в точці, де промінь вдаряє об поверхню.
Якщо кут падіння промення на плоске дзеркало дорівнює 350, то кут між відбитим променем і площиною дзеркала становить:
варіанти відповідей
Кут падіння променя дорівнює 25°. Чому дорівнює кут між падаючим і відбитим променями?
варіанти відповідей
варіанти відповідей
Проходження світла через прозорі середовища
Явище розкладання світла на кольори
Джерело світла розмірами якого можна знехтувати, порівняно з відстанню, на якій оцінюється дія цього джерела називають
варіанти відповідей
Джерело світло у геометричній оптиці
Вежа на 6 м вища за дерево,що стоїть рядом.Довжина тіні від дерева дорівнює 27 метрів.Тінь від вежі на 9 м довша за тінь від дерева.Визначте висоту вежі.
варіанти відповідей
Кут між падаючим і відбитим променями становить 70°. Під яким кутом до дзеркала падає світло?
варіанти відповідей
Коли світловий промінь падає на білий аркуш паперу, спостерігається:
варіанти відповідей
поглинання більшої частини світла
Зображення предмета в плоскому дзеркалі є:
варіанти відповідей
Коли свічку, розташовану на відстані 30 см від плоского дзеркала, перемістили на 20 см ближче до дзеркала, її зображення в дзеркалі:
варіанти відповідей
перемістилося на 10 см ближче до дзеркала
перемістилося на 20 см ближче до дзеркала
енями та горизонтальною площиною дорівнює 380. Під яким кутом до горизонту треба розташувати плоске дзеркало, щоб освітити сонячним зайчиком дно глибокого колодязя?
варіанти відповідей
Два вертикальних плоских дзеркала розташовані на двох сусідніх стінках кімнати. На одне з них падає горизонтальний промінь світла, який після відбивання падає на інше дзеркало. Як зміниться напрям поширення світла після відбивання від двох дзеркал?
варіанти відповідей
напрям зміниться на протилежний
відіб'ється перпендикулярно поширенню світля
Додому- П. 25 ,26 ,впр. 25 ( 3-4)
30-01-2026 р.
ГЕОМЕТРІЯ
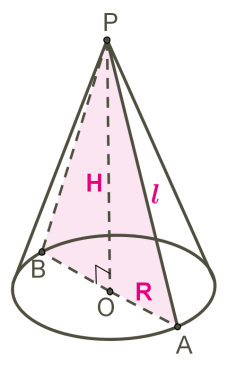
КОНУС
Конус — тіло обертання, утворене в результаті обертання прямокутного трикутника навколо його катета.
Трикутник POA обертається навколо сторони PO.
PO — вісь конуса і висота конуса.
P — вершина конуса.
PA — твірна конуса.
Коло з центром O — основа конуса.
AO — радіус основи конуса.
Осьовий переріз конуса — це переріз конуса площиною, яка проходить через вісь PO конуса.
Осьовий переріз конуса — це трикутник.
APB — осьовий переріз конуса.
∡PAO=∡PBO — кути між твірними і основою конуса.
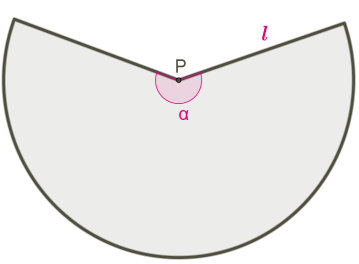
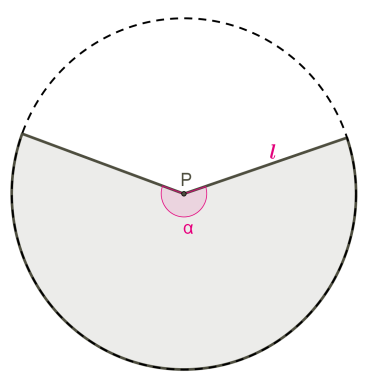
Розгорткою бічної поверхні конуса є круговий сектор. Довжина дуги сектора — це довжина кола основи конуса довжиною
2πR, кут розгортки бічної поверхні
α.
У конусі не можна позначити кут розгортки.
На розгортці конуса не можна позначити висоту й радіус конуса.
Радіус сектора — це твірна конуса.
Таким чином, бічна поверхня конуса є частиною повного кола з радіусом l:
Sбіч.=πl2⋅α360°
Довжина дуги також є частиною довжини повного кола з радіусом l, але в той же час довжина дуги — це довжина кола основи конуса з радіусом R.
Порівняємо вирази довжини дуги й виразимо α через R:
Отримуємо ще одну формулу бічної поверхні конуса, не використовується кут розгортки бічної поверхні:
Sбіч.=πl2⋅R⋅360°360°⋅l=πRl
Прямим круговим конусом називають тіло, утворене обертанням...
варіанти відповідей
кола навколо його діаметра
прямокутної трапеції навколо її сторони
паралелограма навколо його сторони
прямокутника навколо його сторони
прямокутного трикутника навколо одного із катетів
Відрізок, який сполучає вершину конуса з межею основи конуса називається .....
варіанти відповідей
Осьовим перерізом конуса є:
варіанти відповідей
Площина, паралельна площині основи конуса, перетинає конус по :
варіанти відповідей
Якщо радіус основи конуса дорівює R, а висота - H, то твірна дорівнює:
варіанти відповідей
Висота конуса дорівнює 9 см, а твірна - 15 см. Знайдіть радіус основи конуса.
варіанти відповідей
ДОДОМУ- П. 6 , впр. 6.4 , 6.6 .
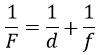 , де
, де![]() см2 Б 18
см2 Б 18![]() см2 В 36
см2 В 36 ![]() см2 Г 48
см2 Г 48 ![]() см2 Д 72
см2 Д 72 ![]() см2
см2![]() см2 Б 81
см2 Б 81![]() см2 В 144
см2 В 144![]() см2 Г 169
см2 Г 169 ![]() см2 Д 225
см2 Д 225![]() см2
см2![]() висоту конуса, якщо діаметр основи конуса,
висоту конуса, якщо діаметр основи конуса,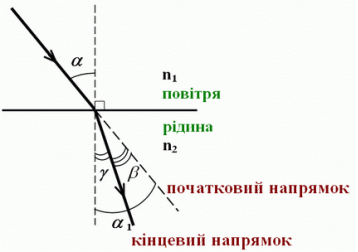
![]() Дано: Розв’язання
Дано: Розв’язання![]() β- ?
β- ?
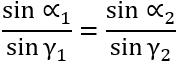
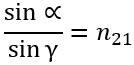 , де
, де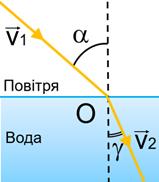
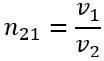
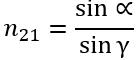 , тому
, тому 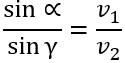
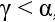 ;
;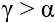 .
.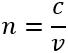
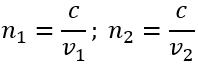 ,
,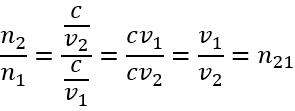 , отже:
, отже: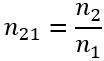 , де
, де
















Коментарі
Дописати коментар